Королевство бутан
Содержание:
Бутан, формула, газ, характеристики:
Бутан – органическое вещество класса алканов, состоящий из четырех атомов углерода и десяти атомов водорода. Название происходит от корня «бут-» (французское название масляной кислоты – acide butyrique) и суффикса «-ан» (что означает принадлежность к алканам).
Химическая формула бутана C4H10. Имеет два изомера н-бутан и изобутан. В химии название «бутан» используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана.
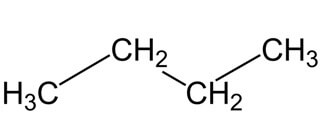
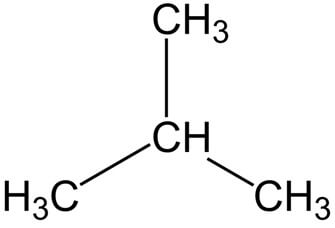
Рациональная формула н-бутана CH3-CH2-CH2-CH3, изобутана CH(CH3)3.
Строение молекулы н-бутана:
Строение молекулы изобутана:
Бутан – бесцветный газ, без вкуса, со специфическим характерным запахом.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Бутан по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Применение и использование бутана:
– в качестве топлива в смеси с пропаном в быту для приготовления пищи, транспортных средствах, в отопительных приборах и т.п.;
– н-бутан используется как сырьё в химической и нефтехимической промышленности для получения бутилена, 1,3-бутадиена, компонентов бензинов с высоким октановым числом, для производства других химических веществ;
– в пищевой промышленности как пищевая добавка E943a и E943b (изобутан), последний используется в качестве пропеллента;
– изобутан используется как хладагент в холодильниках, холодильных камерах, холодильных установках и системах кондиционирования воздуха. Используется самостоятельно или в смеси с пропаном. В отличие от других хладагентов данная смесь и изобутан не разрушают озоновый слой.
Примечание: Фото //www.pexels.com, //pixabay.com
Найти что-нибудь еще?
карта сайта
газовая газ редуктор газовый баллон метан бутан этан бутан пропен цена купить реакции 1 4 50 3 какой кислород вещество авто температура кг воздух водазаправка баллонов бутаномсколько литров стоимость сгорание уравнение реакций давление смесь расход объем литр бутанасжиженный бутан
Коэффициент востребованности
14 351
Популярные достопримечательности
-
Тхимпху-чортен
-
Монастырь Танго
-
Бутанская национальная библиотека
-
Бутанский музей текстиля
-
Дворец Деченчолинг
-
Дунце Лакханг
-
Крепость Друкгьял Дзонг
-
Кьичу Лакханг
Все достопримечательности
Кухня Бутана
Основным ингредиентом бутанской кухни является рис. Его используют повсеместно. Почти ко всем блюдам добавляется перец чили. Популярными мясными блюдами являются мясные клецки, свинина с бобами, жареное с овощами мясо птицы и отварные свиные ножки. Также часто применяют различные овощи и грибы, в стране их насчитывается более 400 видов. Из напитков самым традиционным является бутанский чай с маслом «соуза». Также употребляют черный и зеленый чай, добавляя перец, масло и соль. Из алкоголя наиболее распространены самогон и пшеничное пиво.
Чаевые
Чаевые в Бутане не приняты, однако небольшое дополнительное вознаграждение обслуживающему персоналу по усмотрению гостя только приветствуется. Гиды и водители экскурсионных автобусов ожидают небольших чаевых (обычно $2-3 в день), проводникам в пеших маршрутах высокой категории сложности можно заплатить 7-10 долларов за трек.
Часы работы учреждений
Банки работают с понедельника по пятницу с 10.00 до 13.00. Некоторые небольшие офисы могут быть открыты в субботу или в воскресенье с 10.00 до 12.00-13.00.
Безопасность
Рекомендуется профилактика холеры, гепатита A, В и Е, тифа, бешенства и менингита. Некоторая опасность заражения японским энцефалитом существует в южных областях. Риск заражения малярией высок в южных областях.
Отдельную опасность представляет высотная болезнь, особенно проявляющая себя при восхождениях или, у неподготовленных туристов, даже на несложных маршрутах при высотах от 2500 м.
Экстренные телефоны
В каждом районе Бутана своя служба спасения, номера экстренных служб можно найти в местном справочнике. В столице для вызова скорой помощи используется номер 112, полиции — 113, пожарной службы — 110.
Национальные особенности Бутана. Традиции
Телевидение на всей территории Бутана запрещено, домашние телевизоры используются обычно только для просмотра видеофильмов. Однако большинство отелей оснащены системами спутникового телевидения с большим выбором телеканалов.
Территории крупных заповедников и некоторых религиозных центров закрыты для туристов, что объясняется заботой об уединении монастырей и сохранении местной флоры и фауны.
Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
- 2. галогенирование бутана:
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
и т.д.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование бутана:
См. нитрование этана.
- 4. окисление (горение) бутана:
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование бутана:
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
- 6. сульфоокисление бутана:
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Физические свойства бутана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 601,2 |
| Плотность (состояние вещества – газ, при 0 °C), кг/м3 | 2,672 |
| Температура плавления н-бутана, °C | -138,4 |
| Температура плавления изобутана, °C | -159,6 |
| Температура кипения н-бутана, °C | -0,5 |
| Температура кипения изобутана, °C | -11,7 |
| Температура самовоспламенения, °C | 372 |
| Критическая температура*, °C | 152,01 |
| Критическое давление, МПа | 3,797 |
| Критический удельный объём, м3/кг | 228 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 1,4 до 9,3 |
| Удельная теплота сгорания, МДж/кг | 45,8 |
| Молярная масса, г/моль | 58,12 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.